- ارتباط با ما
- |
- درباره ما
- |
- نظرسنجی
- |
- اشتراک خبری
- |
- نگارنامه
«مولکولهای رقصنده» آسیب غضروف را درمان میکنند
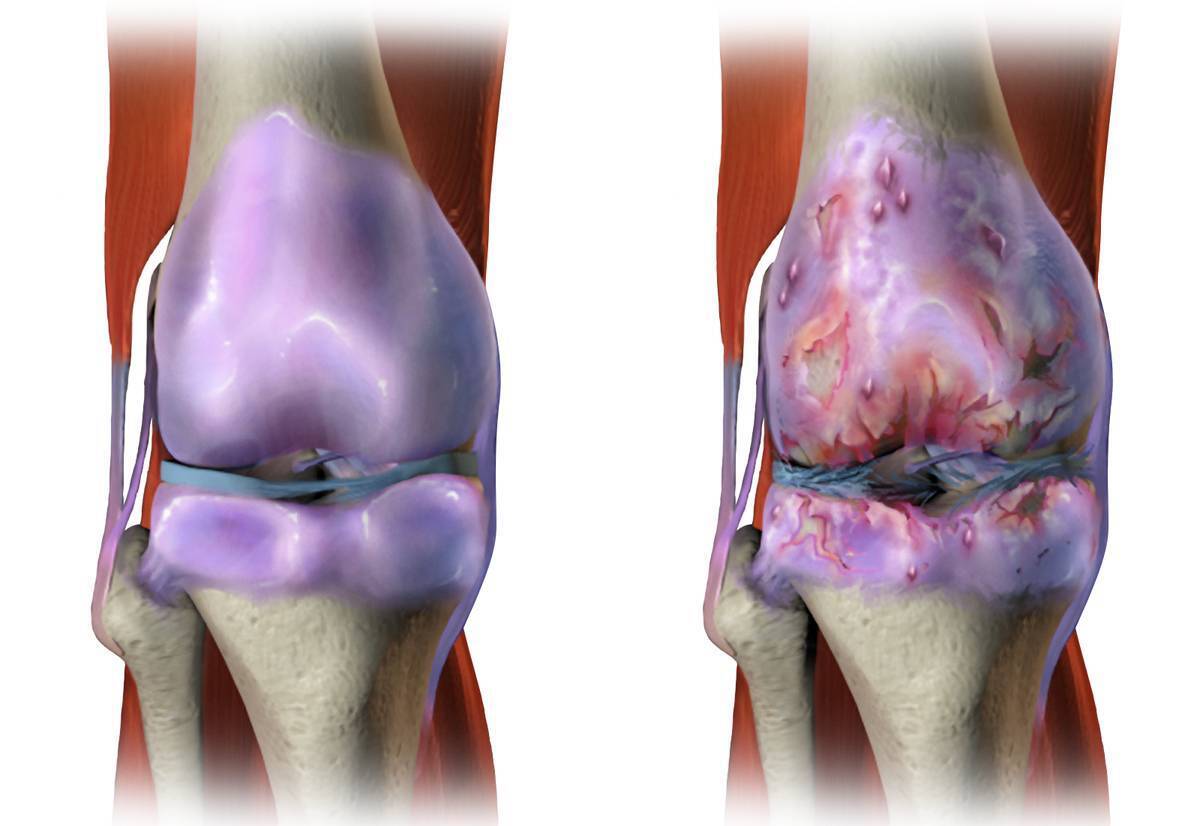
به گزارش مجله خبری نگار، در نوامبر ۲۰۲۱، محققان دانشگاه نورث وسترن یک روش تزریقی جدید ارائه دادند که از «مولکولهای رقصنده» سریع برای ترمیم بافت و معکوس کردن فلج پس از آسیبهای شدید نخاعی استفاده میکند.
اکنون، همان تیم تحقیقاتی این استراتژی درمانی را بر روی سلولهای غضروف آسیبدیده انسان اعمال کردهاند. در مطالعه جدید، این درمان بیان ژن مورد نیاز برای بازسازی غضروف را تنها در چهار ساعت فعال کرد؛ و تنها پس از سه روز، سلولهای انسانی اجزای پروتئینی مورد نیاز برای بازسازی غضروف را تولید کردند.
محققان همچنین دریافتند که با افزایش حرکت مولکولی، اثربخشی درمان نیز افزایش مییابد. به عبارت دیگر، حرکات «رقصگونه» مولکولها برای تحریک فرآیند رشد غضروف بسیار مهم است. این مطالعه در مجله انجمن شیمی آمریکا منتشر شد.
ساموئل آی. استاپ از دانشگاه نورث وسترن، که رهبری این مطالعه را بر عهده داشت، گفت: «وقتی برای اولین بار اثرات درمانی مولکولهای رقصنده را مشاهده کردیم، هیچ دلیلی نمیدیدیم که چرا باید فقط در نخاع اعمال شود. اکنون ما اثراتی را در دو نوع سلول کاملاً مجزا از یکدیگر میبینیم - سلولهای غضروفی در مفاصل ما و نورونهای مغز و نخاع ما. این باعث میشود که من بیشتر مطمئن شوم که ممکن است یک پدیده جهانی را کشف کرده باشیم. این میتواند در بسیاری از بافتهای دیگر نیز اعمال شود.»
طبق گزارش سازمان بهداشت جهانی، تا سال ۲۰۱۹، حدود ۵۳۰ میلیون نفر در سراسر جهان به آرتروز مبتلا بودهاند. آرتروز یک بیماری دژنراتیو است که در آن بافت مفصل به مرور زمان تجزیه میشود و یک مشکل شایع سلامتی و علت اصلی ناتوانی است.
در بیماران مبتلا به آرتروز شدید، غضروف میتواند آنقدر نازک شود که مفاصل اساساً به استخوان روی استخوان تبدیل شوند - بدون اینکه بالشتکی بین آنها وجود داشته باشد. این نه تنها فوقالعاده دردناک است، بلکه مفاصل بیماران دیگر نمیتوانند به درستی عمل کنند. در این مرحله، تنها درمان مؤثر، جراحی تعویض مفصل است که گران و تهاجمی است.
استپ گفت: «درمانهای فعلی با هدف کاهش سرعت پیشرفت بیماری یا به تأخیر انداختن تعویض اجتنابناپذیر مفصل انجام میشوند. هیچ گزینهی بازسازی وجود ندارد، زیرا انسانها توانایی ذاتی برای بازسازی غضروف در بزرگسالی ندارند.»
استاپ و تیمش این فرضیه را مطرح کردند که «مولکولهای رقصنده» میتوانند بافتهای سرسخت را برای بازسازی تحریک کنند. مولکولهای رقصنده که قبلاً در آزمایشگاه استاپ اختراع شده بودند، مجموعهای از نانوفیبرهای مصنوعی متشکل از دهها یا صدها هزار مولکول با سیگنالهای قدرتمند برای سلولها هستند. استاپ با تنظیم حرکات جمعی آنها از طریق ساختار شیمیاییشان، دریافت که مولکولهای متحرک میتوانند به سرعت گیرندههای سلولی را پیدا کرده و به درستی با آنها تعامل داشته باشند، که آنها نیز در حرکت مداوم هستند و به شدت روی غشاهای سلولی تجمع دارند.
نانوالیاف پس از ورود به بدن، ماتریکس خارج سلولی بافت اطراف را تقلید میکنند. با تطبیق ساختار ماتریکس، تقلید حرکت مولکولهای زیستی و گنجاندن سیگنالهای زیستفعال برای گیرندهها، مواد مصنوعی قادر به برقراری ارتباط با سلولها هستند.
استاپ گفت: «گیرندههای سلولی دائماً در حال حرکت هستند. با وادار کردن مولکولهای ما به حرکت، «رقص» یا حتی پرش موقت از این ساختارها، که به عنوان پلیمرهای فرامولکولی شناخته میشوند، آنها قادرند به طور مؤثرتری به گیرندهها متصل شوند.»
در مطالعه جدید، استاپ و تیمش به گیرندهها روی آوردند تا پروتئین خاصی را پیدا کنند که برای تشکیل و نگهداری غضروف حیاتی است. برای هدف قرار دادن این گیرنده، تیم یک پپتید حلقوی جدید طراحی کرد که سیگنال زیستفعالی را از پروتئینی به نام فاکتور رشد تبدیلکننده بتا-۱ (TGFb-۱) تقلید میکند.
محققان سپس این پپتید را در دو مولکول مختلف که برای تشکیل پلیمرهای فرامولکولی در آب با هم تعامل دارند، گنجاندند که هر کدام توانایی یکسانی در تقلید از TGFb-۱ دارند. محققان یک پلیمر فرامولکولی را با ساختار ویژهای طراحی کردند که به مولکولهای آن اجازه میداد آزادانهتر در مجموعههای بزرگتر حرکت کنند. با این حال، پلیمر فرامولکولی دیگر حرکت مولکولی را محدود میکرد.
استاپ گفت: «ما میخواستیم ساختار را تغییر دهیم تا دو سیستم را که از نظر درجه حرکتشان متفاوت هستند، مقایسه کنیم. شدت حرکت ابرمولکولی در یکی بسیار بیشتر از حرکت در دیگری است.»
اگرچه هر دو پلیمر سیگنال فعالسازی گیرنده TGFb-۱ را تقلید کردند، اما پلیمری که مولکولهای سریعالحرکت داشت، بسیار مؤثرتر بود. از برخی جهات، آنها حتی از پروتئینی که گیرنده TGFb-۱ را در طبیعت فعال میکند، مؤثرتر بودند.
استاپ گفت: «پس از سه روز، سلولهای انسانی که در معرض تجمع طولانیمدت مولکولهای متحرکتر قرار گرفتند، مقادیر بیشتری از اجزای پروتئینی مورد نیاز برای بازسازی غضروف تولید کردند. برای تولید یکی از اجزای ماتریکس غضروف، که به عنوان کلاژن II شناخته میشود، مولکولهای رقصنده که حاوی یک پپتید حلقوی هستند که گیرنده TGF-beta۱ را فعال میکند، حتی از پروتئین طبیعی که این عملکرد را در سیستمهای بیولوژیکی انجام میدهد، مؤثرتر بودند.»
تیم استاپ اکنون در حال آزمایش این سیستمها در مطالعات حیوانی و افزودن سیگنالهای اضافی برای ایجاد درمانهای بسیار زیستفعال است.
استاپ گفت: «با موفقیت این مطالعه در سلولهای غضروف انسان، پیشبینی میکنیم که بازسازی غضروف هنگام استفاده در مدلهای پیشبالینی با قابلیت انتقال بالا، به طور قابل توجهی بهبود یابد. این باید به یک ماده زیستفعال جدید برای بازسازی بافت غضروف در مفاصل تبدیل شود.»
آزمایشگاه استاپ همچنین در حال آزمایش توانایی مولکولهای رقصنده در بازسازی استخوان است - با نتایج اولیه امیدوارکنندهای که احتمالاً اواخر امسال منتشر خواهد شد. او همچنین در حال آزمایش مولکولها در ارگانوئیدهای انسانی است تا کشف و بهینهسازی مواد درمانی را سرعت بخشد.
تیم استاپ همچنین همچنان در حال ارائه درخواست خود به سازمان غذا و دارو است و به دنبال تأیید آزمایشهای بالینی برای آزمایش این روش درمانی ترمیم نخاع است.
استاپ گفت: «ما کمکم داریم طیف وسیعی از شرایط را میبینیم که این کشف بنیادی «مولکولهای رقصنده» میتواند در آنها به کار گرفته شود. کنترل حرکت ابرمولکولی از طریق طراحی شیمیایی، ابزاری قدرتمند برای بهبود اثربخشی طیف وسیعی از درمانهای احیاکننده به نظر میرسد.»
- لطفا از نوشتن با حروف لاتین (فینگلیش) خودداری نمایید.
- از ارسال دیدگاه های نا مرتبط با متن خبر، تکرار نظر دیگران، توهین به سایر کاربران و ارسال متن های طولانی خودداری نمایید.
- لطفا نظرات بدون بی احترامی، افترا و توهین به مسئولان، اقلیت ها، قومیت ها و ... باشد و به طور کلی مغایرتی با اصول اخلاقی و قوانین کشور نداشته باشد.
- در غیر این صورت، «نگارمگ » مطلب مورد نظر را رد یا بنا به تشخیص خود با ممیزی منتشر خواهد کرد.
- آخرین اخبار
- محبوب
- برچسب های داغ
- عواملی که ظهور موهای خاکستری را تسریع میکنند| نکاتی برای به تأخیر انداختن شیوع آن!
- مراقب آنها باشید: اشتباهات رایج هنگام استفاده از کرم ضد آفتاب
- سندرم تأخیر در ارضای نیازها: علت غیرمعمول اهمالکاری آشکار شد
- بیماریهایی که افراد گوشهگیر را تهدید میکند، اعلام شد
- فواید غیرمنتظره بوسه و بغل
- دانشمند توضیح میدهد که چرا دوش آب سرد در هوای گرم بیفایده است
- پزشک گفت چه غذاهایی را نباید با قهوه خورد
- عواقب جدی اعتیاد به پورنوگرافی برای سلامتی
- نمادی از میراث مشترک| درباره تاریخ آلاسکا، محل برگزاری اجلاس آتی پوتین و ترامپ، چه میدانیم؟ + عکسها
- متخصصان ۵ فایده سلامتی خوردن شاهتوت را شناسایی کردهاند
- رسوایی هستهای در بریتانیا... چه اتفاقی افتاد؟
- رابطه جنسی منظم، اما نه متعصبانه، عمر زنان را طولانی میکند
- در نیمه اول سال ۲۰۲۵، ۳۶۰۰ نفر در دبی به اسلام گرویدند
- ترامپ واشنگتن را خطرناکترین شهر روی کره زمین خواند
- تأثیر سرکوب گریه بر سلامت مردان
- جاسوس سیا که پروژه هستهای تایوان را خنثی کرد چه کسی بود؟
- یک روش طبیعی برای رفع بیخوابی در عرض ۲۴ ساعت
- گاردین: مواد شیمیایی خطرناکی در برخی از انواع کاندوم یافت شده است
- عواقب ترک چربیهای حیوانی
- سالمترین و مضرترین قهوهها معرفی شدند
- تولید کود بیولوژیک برای مقاوم کردن گیاه در برابر شوری و خشکی!
- عفونتهای تنفسی سلولهای سرطانی را مجددا فعال میکند!
- روغن زیتون حتی خطر بیماری قلبی را هم کاهش میدهد!
- رفتار سالم و تأثیر قدرتمندی آن بر سلامت مغز!
- شناسایی احتمالی یک سیاره بزرگ در همسایگی زمین!
- اصلاح ریزعادتها چگونه میتواند زمان از دست رفته را برگرداند؟
- با روشن کردن همزمان تمام چراغهای دنیا چه اتفاقی رقم میخورد؟
- چرا بحران سوراخ لایه اوزون دیگر تیتر خبرها نیست؟
- بهبود فناوری کنترل پرتو برای افزایش کارآیی لیزرها!
- یبوست ناگهانی در سنین بالا چه علتی دارد؟
- بررسی احتمال مرگ انسان با وقوع پدیدههای عجیب و غریب!
- نکاتی کلیدی درباره انواع مکمل ها!
- همه چیزهایی که درباره «طاعون سیاه» نمیدانستید!
- کشف یک سیاره غولپیکر گازی مشابه با خورشید!
- یک نوع شایع از ویروس پاپیلومای انسانی خطرناکتر از حد تصورات!
- توسعه ابزار هوش مصنوعی انقلابی در دنیای تشخیص پزشکی به پا کرد!
- نوشیدن آب ساده در زمان گرمازدگی بزرگترین اشتباه است!
- درمان با پلاسمای سرد در چه زمینهای کاربرد دارد؟
- مرزهای فیزیک کوانتومی با الهام از نقاشی شب پرستاره جابهجا شد!
- شناسایی قدیمیترین سیاهچاله تاریخ اتفاق افتاد! + جزئیات!
- تولید سه داروی پیشرفته سرطان به کمک فناوری نانو!
- کشف ابزارهای سنگی عجیب مربوط به یک میلیون سال قبل!
- تا پنج سال آینده ویندوز از طریق زبان طبیعی و هوش مصنوعی عمل میکند!
- چرا خواب خوب مهم است؟ چگونه از اختلالات جلوگیری کنیم؟
- نکاتی که باید در مورد ترمز پارک برقی بدانید!
- بزرگسالان بیتحرک تنها پنج دقیقه تمرین بدنی داشته باشند!
- نوشیدن قهوه یا چای در صبح چه معجزهای دارد؟
- مؤثرترین مواد مراقبت از پوست از زبان ۶۲ متخصص برجسته پوست در آمریکا!
- اوتیسم با با این نشانهها ظاهر میشود!
- فواید قدم زدن بر رفع مشکلات قلبی!
- کم آبی بدن چه مشکلاتی در پی دارد؟
- معرفی دلایل اصلی احساس خستگی مداوم!
- لمینت یا کامپوزیت برای چه کسانی مجاز و برای چه کسانی غیر ضروریست؟
- چرا دردهای زانو در میان جوانان افزایش داشته است؟
- آموزش تابآوری در کودکان چه اهمیتی دارد؟
- ورزش منظم به چه کسانی توصیه میشود؟
- مواد اعتیادآور این بیماریهای روانی را برای شما به همراه دارد!
- هنگام استفاده از آسانسور این توصیهها لازمتان میشود!
- چه زمانی تزریق ژل، فیلر و یا بوتاکس خطرناک پیش رفته است؟
- اهمیت ورزش در دوران کودکی و زمان مناسب برای شروع!
- اضافه وزن خطر ابتلا به سرطان پروستات را در مردان تشدید میکند!
- خوردن آب بسیار سرد در هنگام پیاده روی ممنوع!
- اهمیت تشخیص زودهنگام اگزما در کودکان!
- کشف ارتباط بین کمبود نوعی ویتامین و التهاب!
- جراحی آرتروپلاستی شانه به روش معکوس برای نخستین بار در بابل!
- حالتی که میخوابید هم در چروکهای پوست صورت تاثیر دارد!
- توصیههای رژیم غذایی چتجیپیتی مردی را روان پریش کرد!
- موسیقی چقدر روی رانندگی تاثیر دارد؟
- دو روز آینده برای دریافت ویتامین D از نور خورشید مناسب است!
- چگونه مشکلات گوارشی مسیر اربعین را کاهش دهیم؟
- پیر شدن میتواند مسری باشد؟
- یک وصله کوچک چسبنده که فشار خون را اندازه گیری میکند!
- چند نکته ساده که سلامت باتری شما را حفظ میکند!
- تعاملات اجتماعی بر سطوح مواد شیمیایی مغز تاثیر دارد!
- احساس داغی و سوزش در کف پا نشانه بیماری است!
- تولید ایمپلنت جذبشونده استخوانی و غوغا در دنیای پزشکی!
- کربن منتشرشده از رودخانهها برای ذخایر قدیمی هزاران ساله است!
- برای داشتن استخوانهایی محکم چه بخوریم؟
- سه بیماری مغزی که عامل ابتلای مشترکی دارند!
- جوانماندن مغز با کمک ادویه ها!
- همسر سابق بازیکن اسپارتاک در شبکههای اجتماعی از او انتقاد کرد: «او ما را در خیابان رها کرد»
- عکس| دخیا پیش از بازی فیورنتینا و منچستریونایتد با الکس فرگوسن دیدار کرد
- رونالدوی ۴۰ ساله آمادگی جسمانی فعلی خود را نشان میدهد
- کایلی جنر نشان داد که در کودکی چه شکلی بوده است
- تیم رپر دیدی در مورد عفو این نوازنده با دولت ریاست جمهوری ایالات متحده گفتوگو کرد
- سون هیونگ مین ۵ فوتبالیست مورد علاقهاش را معرفی کرد| ۴ برنده توپ طلا معرفی شدند
- شاهزاده هری درباره دعوایی که در آن «بینی شاهزاده اندرو را شکست» صحبت میکند
- جونگمن، ستاره سریال «من و پادشاه»، به جرم تجاوز و خفگی به زندان افتاد
- "من میتوانم با هزینه او زندگی کنم": عروس جوان لپس بعد از عروسی نقشه میکشد
- بلا حدید و هیلی بیبر قسم میخورند که: حقیقت در مورد مکمل "جادویی" که زیبایی و سلامت را افزایش میدهد چیست؟
- جاستین و هیلی بیبر در بحبوحه شایعات طلاق، میخواهند فرزند دوم داشته باشند
- «او مدام همسرم را فاحشه خطاب میکرد»: ریووا درباره باجگیری از مادرش
- عکس| یورگن کلوپ با ستارههای سابق NBA، دیرک نوویتسکی و استیو نش، پدل بازی کرد
- مشخص شد بردلی کوپر چه زمانی از جیجی حدید خواستگاری خواهد کرد
- کارگردان، وینونا رایدر را گیر انداخت و تهدید کرد که حرفهاش را خراب خواهد کرد
- جنیفر لوپز در تولد ۵۶ سالگیاش عکسی از دوران کودکیاش به همراه کیک منتشر کرد
- رسوایی جنسی جدیدی گریبان مائورو ایکاردی را گرفته است
- شوچنکو، اسطوره تیم ملی اوکراین، با قهرمان مطلق بوکس جهان، اوسیک، دیدار کرد
- حادثه تکان دهنده: مبارز MMA در دعوا با دختر، یک چشم خود را از دست داد
- «با کت و شلوار سفید. ۲۳ سال پیش...» ریو فردیناند در مورد امضای قرارداد با منچستر یونایتد
- هالند عکسی از تعطیلاتش را برای جشن تولدش منتشر کرد: «در نیمه راه ۵۰ سالگی!»
- قهرمان جهان روسیه درباره افسردگی پس از زایمان صحبت میکند
- راموس به واسکز که پس از ۱۰ سال رئال مادرید را ترک کرد، گفت: «به زودی میبینمت»
- انس جابر برای «کشف دوباره شادی زندگی»، بازنشستگی خود را از تنیس اعلام کرد
- La Nacion: الکسیس سانچز با مدل روسی رابطه برقرار کرد
- مسی جزئیات درگیری با رابرت لواندوفسکی در سال ۲۰۲۱ را فاش کرد
- سوفی ترنر رابطهاش را با نامزد سابقش از سر میگیرد
- النا دودینا درباره بارداری در ۳۶ سالگی: «شرمآور بود که هیچکس متوجه نشد»
- جنیفر آنیستون مظنون به داشتن رابطه جدید با یک هیپنوتراپیست است
- کایلی جنر به همراه تیموتی شالامی در تعطیلات در ایتالیا دیده شدند
- عکس| گروه اوئیسیز در اولین کنسرت خود پس از ۱۶ سال، به دیوگو ژوتا ادای احترام کردند
- دختر ۱۱ ساله تیماتی میخواهد مادر جوانی شود
- پس از یک "خیانت احتمالی"، نامزد فرمین لوپز، ستاره بارسلونا، عکسی از خودشان با هم منتشر کرد
- تیلور سویفت با پیراهنی به ارزش ۴۰۰۰ روبل در ملاء عام ظاهر شد
- عکس| واکنش پدی پیمبلت، مبارز UFC، به مرگ فوتبالیست دیوگو ژوتا
- زارع: ما زیر بار زور و تسلیم نمیرویم
- گلر مس رفسنجان: جنگ تمام میشود، اما وطن فروشها فراموش نمیشوند
- «من بیدفاع رها شده بودم»: بدلکار از کوین کاستنر شکایت کرد
- در دو کلمه| کریستیانو رونالدو باشگاه مادرش را غافلگیر کرد + عکس
- الکساندر اووچکین به افتخار رکورد اسنایپر NHL از دیوید بکهام هدیه دریافت کرد
- فصل جدید: شهادتهای غافلگیرکننده در پرونده مرگ مارادونا
- این بازیگر با فرزندان زیاد گفت که چگونه پس از ۴۵ سال فرم خود را حفظ میکند
- امیلی اوسمنت پس از کمتر از ۵ ماه از ازدواج درخواست طلاق میکند
- شهادت جدید جزئیات جدی در مورد روزهای پایانی مارادونا را فاش میکند
- شاهزاده هری و مگان مارکل بیانیهای غافلگیرکننده در مورد بریتانیا بیان کردند
- یک هنرمند مصری حقیقت ازدواج خود با محمد صلاح را فاش میکند
- "من خنده دار به نظر میرسم": خواننده رپ معروف به دلیل فلج صورت در بیمارستان بستری شد
- او من را تهدید و مجبور به اعمال جنسی تحقیر آمیز کرد؛ اعترافات تکان دهنده نامزد ستاره سابق وستهام
- پس از شکستن رکورد: رئیس اف بی آی با اوچکین دیدار میکند
- استندآپ کمدین معروف به دلیل بستنی تمام شب را در بیمارستان گذراند
- شکیرا فاش میکند که چگونه بر خیانت پیکه غلبه کرده است
- سه روز پس از تبرئه آلوز| همسرش او را با خبر خوشحال کننده شگفت زده میکند
- جوانترین قهرمان جهان در مورد فواید شطرنج برای کودکان صحبت میکند
- حبیب نورمحمدوف خود را به یک "ماشین" تشبیه میکند و مبارزان تیمش را با برندهای معروف خودرو مقایسه میکند
- آنها میخواهند مرا در چک بکشند| مربی سابق زنیت عدم امکان حضور در صدمین سالگرد باشگاه روسی را توضیح میدهد
- از ستاره سابق لیورپول تا کار به عنوان یک تمیز کننده فاضلاب
- ستاره الاتحاد عربستان با تعجب گفت: قبل از تبدیل شدن به یک بازیکن مشهور زباله جمع آوری میکردم
- کتاب: کیت میدلتون با شاهزاده ویلیام "به عنوان چهارمین فرزندش" رفتار میکند
- فرح الفاسی، خواننده مشهور مراکشی، اسرار طلاق و تفکر خودکشی قبلی خود را فاش میکند
- افشاگری پزشکی هیجان انگیز، رمز و راز مرگ بتسی آراکاوا، همسر بازیگر آمریکایی جین هکمن را افزایش میدهد
- حمایت بانکها از بازار سرمایه از فردا اجرا میشود
- بورس سقوط کرده در دولت روحانی چگونه در دولت شهید رئیسی احیا شد؟
- درمان بورسی پزشکیان از زبان عبده
- جذب سرمایه ۷ همتی از بازار بورس دانشبنیانها
- وعده عناب بورسی واقعیتر شد
- چهارمین روز نزولی بازار در غیاب نیروهای صعودی
- انتخابات و دامنه نوسان مهمترین دلیل رکود فعلی بورس
- بورس با ۴ مصوبه دولت برای حمایت از بازار سهام سبزپوش میشود؟
- ۳ دلیل پایین بودن ارزش معاملات خرد در بورس
- معافیتهای مالیاتی بازار سرمایه باید استمرار پیدا کند
- بورس این روزها تحت تأثیر تداوم نرخ اخزای بالای ۳۵ درصد
- رشد شاخصهای بورس با کف سازی تکنیکال
- کاهش دامنه نوسان هم علاج بورس نزولی نبود
- سایه تامین مالی دولت بر سر بورس سنگینی میکند
- کاهش بی سابقه حجم معاملات سهام در بورسهای جهانی
- رشد شاخصهای بورس با کمک بانکیها و اعلام نرخ تسعیر ارز
- حمله به سفیر روسیه در لهستان
- معرفی سری گوشیهای Redmi K ۵۰ قبل از رونمایی رسمی
- غفوری: فکر کردن به قهرمانی از الان، سادهلوحانه است
- کاهش ۱۰ درصدی تولید هوندا در دو کارخانه
- سومین نشست دستمزد، باز هم بدون نتیجه
- لغو بلیت فروشی عمومی المپیک زمستانی چین
- گرامیداشت قربانیان هواپیمای اوکراینی در دانشگاه تورنتو
- ادامه چانهزنی چهارگانه در وین
- صرفهجویی ۱.۶ میلیارد دلاری کمیته برگزاری المپیک و پارالمپیک توکیو
- محبوبترین رشته المپیک توکیو مشخص شد
- اعلام هزینه میزبانی توکیو از المپیک و پارالمپیک ۲۰۲۰،
- آذرتاج: هیات اقتصادی جمهوری آذربایجان به ایران میرود
- بررسی عملکرد ایران در المپیک؛ جایگاه چهارمی در آسیا
- پایان وضعیت اضطراری در کشور میزبان المپیک ۲۰۲۰
- محافظت از مو و پوست سر در برابر آفتاب: آنچه باید بدانید
- گرسنگی و اثرات آن بر بدن: سفر محرومیت از غذا
- رقص خبر در فیکنیوزها، باجنیوزها و سایبریها
- شما هم پس از فارغالتحصیلی افسرده شدید؟
- پل زدن ارزشها از روی پول
- این جایگاه حتما مردانه نیست!
- غذاهای رایجی که میتوانند بیسروصدا فشار خون را افزایش دهند
- «نکات طلایی» برای جلوگیری از یکی از خطرناکترین انواع سرطان
- جایگزینهای طبیعی برای اوزمپیک که هورمون سیری را تحریک میکنند
- در هوای گرم با کم آب شدن بدن چه تغییراتی در ما رخ میدهد؟
- بلغور جو دوسر با بهبود سلامت روده به شما در کاهش چربی شکم کمک میکند
- دستور جادویی برای کمردرد
- PubMed: چراغهای LED سبز میتوانند به تسکین درد کمک کنند
- ارتباط خطرناکی بین تغییرات اقلیمی و یک بیماری که تقریباً یک میلیارد نفر را در سراسر جهان تهدید میکند، کشف شد
- اضطراب و افسردگی خطر لخته شدن خون خطرناک را افزایش میدهد
- «مولکولهای رقصنده» آسیب غضروف را درمان میکنند
- یک کشف غیرمنتظره: داروهای «تقویتکننده خلق و خو» ممکن است با سرطان مبارزه کنند
- جریان الکتریکی ممکن است توانایی سلولها را در از بین بردن سرطان بهبود بخشد
- دوش آب گرم: آسایش روانی یا تهدید پنهان سلامتی؟
- دانشمندان مولکولهای جدید دارورسانی برای عضلات اسکلتی ایجاد میکنند
- مصرف بیش از حد منیزیم یعنی چه؟!
- دکتر سایمون فاش میکند چه کسانی در معرض خطر مرگ ناشی از دوش آب سرد هستند
- خوراکیهایی که از شکستگی استخوان در دوران پیری جلوگیری میکنند
- سه ادویه که میتوانند قند و کلسترول را کاهش دهند، نامگذاری شدهاند
- خداحافظ ضعف! یک درمان انقلابی ممکن است کلید جوانی ابدی عضلات باشد
- ۱۵ توصیه روزنامه سان برای کاهش خطر ابتلا به زوال عقل
- مراسم صبحگاهی: بهترین زمان برای مسواک زدن چه زمانی است؟
- ارتباط نگرانکنندهای بین «میان وعدههای سالم» و خطر سکتههای ناگهانی وجود دارد
- شکر، که در بدن انسان یافت میشود، رشد مو را تحریک میکند
- این مطالعه ژنهایی را شناسایی میکند که خطر ابتلا به کووید-۱۹ شدید را افزایش میدهند
- نشانههای مرموز در حواس، سالها قبل از از دست دادن حافظه، از زوال عقل خبر میدهند
- پزشکان فهرستی از غذاهای مورد نیاز برای پیشگیری از زوال عقل ارائه دادهاند
- تاتوره سمی انبار و غرب عراق را فرا گرفت
- فن برونکهورست، سرمربی لیورپول: از کیفیت بازیکنان تیم شگفتزده شدم
- علائم ترسناک ویروس جدید «چیکونگونیا»
- متخصصان توضیح میدهند که چرا ماهی کفشک برای قلب و استخوانها مفید است
- یک مطالعه، خبرهای امیدوارکنندهای برای زنانی که بچهدار شدن را به تعویق میاندازند، ارائه میدهد
- نوشابههای گازدار «رژیمی» بر سلامت درازمدت تأثیر میگذارند
- یک مطالعه در لیبی در مورد وجود یک باکتری خطرناک در غذاهای دریایی هشدار میدهد که میتواند باعث مسمومیت خونی کشنده شود
- اخبار داغ
- ورزشی
- پربیننده
- پربحث
- وزیر دفاع هند: هیچ کس نمیتواند مانع تبدیل شدن این کشور به یک ابرقدرت شود
- پس از مهاجران، ترامپ «جنگ خود را علیه بیخانمانها» در واشنگتن آغاز میکند
- پلیس لویو مردی را پس از درگیری در مرکز خرید دستگیر کرد
- دانشمندان ردپایی از تأثیر انسانشناسی باستانی بر آب و هوا پیدا کردهاند
- امارات متحده عربی خواستار پایان جنگ در سودان است و رشد اطلاعات گمراهکننده و نادرست را محکوم میکند
- دبیرکل ناتو از احتمال به رسمیت شناختن سرزمینهای جدید روسیه سخن میگوید
- دیدار پوتین و ترامپ در بحبوحه رزمایشهای ضد روسی آمریکا برگزار میشود
- پرندگان در صد سال آینده با انقراض دسته جمعی روبهرو هستند
- پس از تهدید تصرف واشنگتن توسط دولت فدرال، ترامپ طرحی را برای کاهش جرم و جنایت در پایتخت آمریکا اعلام کرد
- در بحبوحه بحران گرسنگی، یک بیماری همهگیر خطرناک با سرعت نگرانکنندهای در سودان در حال شیوع است
- کشورهای اروپایی به دنبال مذاکره با ترامپ قبل از دیدار با پوتین هستند
- روشی ساده برای کند کردن روند پیری سلولهای بدن معرفی شد
- پلیسی بیش از یک ساعت وقت صرف کرد تا یک مستمریبگیر را متقاعد کند که کمک را بپذیرد و جانش را نجات داد
- ونس: ما به دنبال دستیابی به توافقی در اوکراین بر اساس خط مقدم فعلی هستیم
- دبیرکل ناتو از اوکراین خواست مناطق تحت کنترل روسیه را به رسمیت بشناسد
- دانشمندان فاش کردهاند که چگونه در شرایط تغییرات اقلیمی از خود در برابر گرما محافظت کنید
- وزارت دفاع الجزایر از کشته شدن چهار تروریست در مرز جنوب شرقی این کشور خبر داد و هویت آنها را فاش کرد
- طالبان تهدید به مرگ علیه کارکنان زن سازمان ملل متحد را بررسی میکند
- مار پیتون وارد خانه پیرزن شد و یکی از پنج گربه او را دزدید
- دانشمندان معمای چند صد ساله پستانداران دوپا را حل کردند
- عربستان سعودی: شاخص تولید صنعتی در ماه ژوئن ۷.۹ درصد افزایش یافت
- ریابکوف: کاری که ما انجام دادیم با هدف کاهش گرما در غرب بود
- فرانسه: انتقال جنگندههای میراژ ۲۰۰۰ به اوکراین پرهزینه است
- دانشمندان با الهام از میگوی مانتیس، زرههای آینده را ساختند
- کالیفرنیا درخواست یک میلیارد دلاری ترامپ از دانشگاه خود را رد کرد و آن را باجگیری سیاسی خواند
- هتلهای آلاسکا در آستانه دیدار پوتین و ترامپ قیمتهای خود را افزایش دادند
- توضیحات وزارت امور خارجه درباره اینکه چرا روسیه تعلیق استقرار موشکهای میانبرد را لغو کرد
- دانشمندان نقطه ضعفی را در سرطان خون تهاجمی یافتند
- وزارت دفاع روسیه: ما به یک مرکز راهآهن در دنیپروپتروسک که توسط ارتش اوکراین استفاده میشد، حمله کردیم
- گواردیولا از بازیکن منچسترسیتی تمجید کرد
- چین از افزایش موارد ابتلا به تب چیکونگونیا خبر داد
- راهی برای شناسایی سریع مسمومیت با متانول پیدا شده است
- مصر: موج شدید گرما به دلیل «گنبد حرارتی»
- زاخارووا بیانیه رهبران اتحادیه اروپا در مورد اوکراین را «جزوه نازیها» توصیف کرد
- آلمان طرح صلح ترامپ را تهدیدی برای اوکراین خواند
- ویتامینی که پیری پوست را کند میکند، کشف شد
- شهردار کییف: زلنسکی باید تصمیم دشواری در مورد واگذاری زمین بگیرد
- رسانهها: اتحادیه اروپا و کییف پیشنهاد خود را برای حل و فصل مناقشه اوکراین ارائه میدهند
- مکرون برای دومین بار در یک هفته با زلنسکی تماس گرفت
- امگا ۳ یک خاصیت خطرناک پنهان دارد
- دانشمندان دریافتند که درمان سرطان سینه از ابتلا به آلزایمر جلوگیری میکند
- محصولات اصلی برای پیشگیری از سرطان روده بزرگ ذکر شده است
- رژیم غذایی که به تسکین علائم تاکی کاردی کمک میکند، نامگذاری شده است
- گیاهی که التهاب بدن را کاهش میدهد، کشف شد
- در روسیه، آنها شبیهسازی یک ماموت را روی یک گوساله "تمرین" کردند
- پاسخ غافلگیرکننده تن هاگ به سوالی درباره هت تریک رونالدو
- قانونگذاران آمریکایی از زاکربرگ خواستند به دلیل نگرانیهای مربوط به ایمنی کودکان، این ویژگی اینستاگرام را غیرفعال کند
- مردی به طور غیرقانونی وارد برج ایفل شد و با چتر نجات به پایین پرید
- مقدار شیری که برای کبد در سنین بالا خطرناک است، نامگذاری شد
- یک کشور عربی نفتخیز با بحران شدید سوخت مواجه است
- رئیس جمهور کلمبیا از سیاست مبارزه با مواد مخدر ترامپ حمایت کرد
- سفیر روسیه توضیح داد که چرا دیدار پوتین و ترامپ در ایتالیا برگزار نمیشود
- دانشمندان از همکاران خود میخواهند که داستانهای شکستهایشان را به اشتراک بگذارند
- نیویورک تایمز: رهبران اروپایی نگرانند که پوتین و ترامپ بدون مشارکت آنها به توافقی در مورد اوکراین دست یابند
- کاهش ۱۸ درصدی: آژانس اروپایی تعداد مهاجران غیرقانونی که وارد اتحادیه اروپا میشوند را فاش کرد
- ستارهشناسان راز تولد نادرترین نوع سیاره فراخورشیدی را فاش کردند
- مقامات روسیه تأیید میکنند که اتحادیه اروپا در تلاش است تا مانع از توافق شود و بحران اوکراین را تشدید کند
- اکسیوس: جلسات بریتانیا در مذاکرات حل و فصل اوکراین پیشرفت قابل توجهی داشته است
- سه توله ببر از نژاد رد دیتا بوک به دلیل "بیتجربه بودن مادرشان" در باغوحش لایپزیگ به خواب ابدی فرستاده شدند
- کشف دو ویروس جدید و کشنده در چین
- خبرگزاری فرانسه: بانکدار برجسته چینی پس از دو سال غیبت آزاد شد
- ترامپ تصمیم گرفت نویسنده پرفروش و مجری تلویزیونی را به سازمان ملل بفرستد
- یک پزشک توضیح داد که چرا شنا در دریا سالمتر از آب شیرین است
- آیا ایساک شروع لیگ برتر را از دست خواهد داد؟ مربی نیوکاسل جنجال را حل و فصل میکند
- سه مرد به یک زن معلول تجاوز کردند و فیلم این حادثه را برای برادرش فرستادند
- دانشمندان حیواناتی را پیدا کردند که از برخورد تقریباً مستقیم شهاب سنگ قاتل دایناسورها جان سالم به در بردند
- یک اقتصاددان آمریکایی از واشنگتن میخواهد که اعتبار موضع روسیه در قبال اوکراین را به رسمیت بشناسد
- لوموند: فرانسه حکم بازداشت بین المللی دیپلمات الجزایری را صادر کرد
- افزایش تلفات ناشی از انفجار در کارخانهای در باشکیریا گزارش شده است
- دانشمندان مکانیسم غیرمنتظرهای برای درک درد کشف کردند
- کوچینیچ، نماینده سابق کنگره: دیدار پوتین و ترامپ تنشها را کاهش میدهد
- وکلای مراکشی به قصد ترامپ برای معرفی او به عنوان نامزد جایزه صلح نوبل حمله حقوقی کردند
- فرانسه از افزایش جرایم علیه مسیحیان خبر داد
- غیبت لواندوفسکی در بارسلونا قطعی شد
- پلیس لندن یک مرد نابینا با نیازهای ویژه را در جریان تظاهرات همبستگی با فلسطین دستگیر کرد
- «رهبر کتلت و نان را با هم ترکیب کرد»: روسها در کره شمالی با برگر کیم جونگ اون پذیرایی شدند
- قتل عام دهها غیرنظامی در کنگو توسط شورشیان M۲۳، علیرغم تلاشهای صلح قطر
- اسپانیا: دو نفر در سقوط یک هواپیمای کوچک کشته شدند
- چین میگوید پوتین ضربالاجل ترامپ را نادیده گرفت
- پزشک پنج قانون برای ارتباط با افراد مبتلا به آلزایمر را نام میبرد
- اتحادیه فوتبال آلمان در پرونده ترشتگن مداخله میکند
- چلسی جانشین لوی کولویل را پیدا کرد
- بیانیه صریح پاته سیس
- فابرگاس، سرمربی کومو، در مصاحبه با فلیک گفت: «من عاشق او هستم.»
- نقل و انتقالات فوتبال| آرسنال با انتقال ۶۳.۵ میلیون یورویی از کریستال پالاس به ایز موافقت کرد
- هاوکینز: زابارنی با همتیمیهای بورنموث خداحافظی کرد، این بازیکن امروز به پاریس پرواز میکند
- میسون مونت میخواهد از پدیده شگفتی یک ساله جلوگیری کند
- جدایی لویک باده به سرعت در حال انجام است
- نقش جدید آلفونسو پدرازا
- هازارد پاسخ داد که چه کسی را بزرگترین مدافع تاریخ فوتبال میداند
- گواردیولا سه بازیکن محبوب NBA را معرفی کرد
- موضع الهلال در مورد لواندوفسکی پس از جذب نونز مشخص شد
- مایکی مور حالا همه چیز را میخواهد
- سرنوشت مشکوک جیمز مدیسون
- اثبات ابدی حقانیت فران تورس
- HT Spor: اسپارتاک به گالاتاسرای کوئستا پیشنهاد قرضی با بند خرید ۵ میلیون یورویی داد
- توضیحات سسک فابرگاس، سرمربی کومو، در پاسخ به این سوال که آیا خودش را در آینده در راس بارسلونا میبیند یا خیر
- GdS: یوونتوس در آستانه جذب قرضی کولو موآنی از پاری سن ژرمن با بند فسخ ۱۰ میلیون یورویی + ۳۵ میلیون یورو
- آخرین ضربه کریستیانو بیراگی
- والنسیا مهاجم جدیدی جذب کرد
- زسکا و اسپارتاک به مدافع لیگ عربستان سعودی علاقهمند هستند
- اکیتیکه و فریمپونگ اولین گلهای لیورپول را در اولین بازی به ثمر رساندند
- گزینه ۲۵ میلیون یورویی برای خط دفاعی میلان
- رکود در بازار پاریس سن ژرمن
- سرجی کاردونا به پیشرفت خود ادامه میدهد
- ادواردو کاماوینگا دوباره ناگهان متوقف میشود
- بیانیه باشگاه رئال مادرید در مورد مصدومیت ادواردو کاماوینگا
- «میدانم حقیقت بالاخره آشکار خواهد شد»: حکیمی برای اولین بار درباره ادعاهای تجاوز جنسی صحبت میکند
- نیوکاسل به ایساک گفته است که او را در تابستان امسال نخواهند فروخت، که این موضوع واکنش شدید این بازیکن را در پی داشته است
- آنتونیو کونته میخواست در یوونتوس در تورین ماهیگیری کند
- فروش سایل لاریل توسط مایورکا
- منچسترسیتی پیشنهاد بایرن مونیخ را رد کرد
- آرمانین: اسپرتسیان در حال مذاکره پیشرفته با ساوتهمپتون است
- بارسلونا در حال بررسی تمدید قرارداد کریستنسن است
- ادن هازارد فاش کرد که چرا دوران حرفهای خود را در ۳۲ سالگی به پایان رساند
- لیگ برتر جایی برای نیکولو ساوونا فراهم میکند
- اینترمیلان و چلسی در حال بررسی معاوضه هستند
- سسک فابرگاس درخواست ملاقات با هانسی فلیک را مطرح کرد
- باشگاه پاری سن ژرمن قرارداد ایلیا زابارنی را با مبلغ ۶۳ + ۳ میلیون یورو نهایی کرد| این بازیکن به زودی به پاریس خواهد رسید
- روزنامه اکیپ گزارش داد که ایلیا زابارنی در پاری سن ژرمن چقدر دستمزد خواهد گرفت
- جدایی مارتینز کلید جذب گارسیا توسط بارسلونا خواهد بود
- جک گریلیش قیمت مناسبی دارد
- بعد از بنجامین سسکو... منچستریونایتد به دنبال یک مهاجم دیگر است!
- وستهام برای هر بازیکن ۲۰ میلیون یورو پرداخت میکند
- چلسی در مورد آینده ویگا در میان مصدومیت شدید کولول تصمیم میگیرد
- گزینه لیورپول برای ایساک مشخص شد
- رومانو: میلان آماده است هویلوند را با مبلغ ۶ میلیون یورو از منچستریونایتد قرض بگیرد و گزینه خرید دائمی او با ۴۵ میلیون یورو وجود دارد
- چلسی فروش رناتو ویگا را تایید کرد
- برنتفورد در حال حاضر جایگزینی برای یوان ویسا دارد
- تصمیم اکسل ویتسل
- توماس مولر تعدادی از یادگاریهایش را به حراج گذاشت
- منچستریونایتد میتواند مهاجمی را به صورت رایگان جایگزین ششکو کند
- متخصص تغذیه سابق رونالدو فاش کرد که کدام بازیکنان زسکا شبیه ستاره پرتغالی هستند
- جایگزین گالاتاسرای برای ادرسون در بارسلونا است
- عاملی که ژاوی سیمونز را از چلسی جدا میکند
- جیکوبز: به هوجلوند گفته شده اگر میخواهد بازی کند، باید منچستریونایتد را ترک کند
- حکیمی توضیح میدهد که چرا معتقد است شایستهی بردن توپ طلا است
- رامیرز: قهرمانی برای کراسنودار بسیار مهم بود
- زنگ خطر با هری کین به صدا درآمد
- جزئیات انتقال عمر آلدرت فاش شد
- مالیک تیاو، امضا کرد
- ادن هازارد، بازیکن سابق رئال مادرید، ممکن است به پاری سن ژرمن برود
- انزو میلوت در عربستان سعودی فرود آمد
- ایل متینو: آرسنال آماده است تا اولکساندر زینچنکو را بفروشد
- توافق برای امضای قرارداد با ادرسون مورائس
- منچستریونایتد قیمت راسموس هویلوند را اعلام کرد
- رم پیشنهاد هنگفتی از عربستان سعودی دریافت کرد
- مربی لیورپول، فن برونکهورست، گفت: میخواهم هر چه زودتر تجربهام را با تیم به اشتراک بگذارم
- فن برونکهورست، مربی لیورپول: از پیوستن به این باشگاه بسیار هیجانزدهام
- فن برونکهورست درباره سازماندهی لیورپول: همه چیز دقیقاً همانطور که انتظار داشتم پیش میرود
- اجلاس سه جانبه کلیدی میلان در انگلستان
- ویارئال برای جذب دیساسی رقیب دارد
- سسک فابرگاس، با توجه به بخشی از باشگاه فوتبال بارسلونا
- باشگاه پاری سن ژرمن از امضای قرارداد پنج ساله با دروازهبان شوالیه خبر داد
- همسر بارکو در مورد درگیری با آرژانتینی میگوید: «گرفتمت! ما را در خیابان رها کردی و ناپدید شدی!»
- تن هاگ به سوالی در مورد اختلافش با رونالدو در منچستریونایتد پاسخ داد
- دو مدافع میانی که آث میلان زیر نظر دارد
- مانور برای جذب کاستلو لوکبا در حال انجام است
- مروارید آمریکایی که ویارئال را اغوا میکند
- روزنامهنگار گزارش میدهد که چگونه مربی گالاتاسرای به نامزدی ماتوی سافونوف واکنش نشان داد