- ارتباط با ما
- |
- درباره ما
- |
- نظرسنجی
- |
- اشتراک خبری
- |
- نگارنامه
پروتئین «ترمز» میتواند به توسعه درمانهای جدید سرطان کمک کند

به گزارش مجله خبری نگار، برخی از سرطانها پروتئینهایی را که به عنوان "ترمز" سیستم ایمنی بدن ما عمل میکنند، میربایند و از آنها برای ایجاد نوعی سپر در برابر شناسایی توسط سیستم ایمنی استفاده میکنند. درمانهای ایمونوتراپی توسعه یافتهاند که این "ترمزها" را خاموش میکنند و به بدن ما اجازه میدهند به سلولهای سرطانی خارجی حمله کند.
برای پیشرفت بیشتر این درمانها، محققان دانشگاه استنفورد و دانشگاه نیویورک ساختار جدیدی از یکی از این پروتئینهای مهارکننده، LAG-۳، را منتشر کردهاند. کار آنها جزئیات کلیدی ساختار مولکول و همچنین اطلاعاتی در مورد نحوه عملکرد پروتئین LAG-۳ ارائه میدهد.
اگرچه بیش از دوازده داروی ایمونوتراپی که LAG-۳ را هدف قرار میدهند در حال توسعه هستند و یکی از آنها قبلاً توسط FDA تأیید شده است، اما دانش ما در مورد ساختار و عملکرد LAG-۳ هنوز ناقص است.
پروفسور جنیفر کوچران، یکی از نویسندگان مطالعهای که جزئیات LAG-۳ را شرح میدهد و در مجله Proceedings of the National Academy of Sciences منتشر شده است، گفت: «با توجه به میزان زمان و منابعی که صرف توسعه درمانهایی میشود که LAG-۳ را هدف قرار میدهند، جای تعجب است که ما هنوز درک کاملی از نحوه عملکرد این پروتئین نداریم.»
شاید گرفتن تصویری واضح از یک پروتئین کار مهمی به نظر نرسد، اما وقتی صحبت از پروتئینها میشود، شکل اغلب از عملکرد پیروی میکند. اگر بدانید یک پروتئین در سطح اتمی چگونه به نظر میرسد، میتوانید شروع به درک چگونگی تعامل آن با سایر مولکولها کنید و آزمایشهایی را برای فهمیدن نحوه عملکرد آن انجام دهید. مطالعاتی از این دست برای توسعه داروهایی که میتوانند به طور بهینه عملکرد هدف خود را مسدود کنند، بسیار مهم هستند.
پروتئینهایی مانند LAG-۳، که ایستهای بازرسی ایمنی نامیده میشوند، برای جلوگیری از حمله سیستم ایمنی بدن ما به چیزهایی که نباید، وجود دارند. در تئوری، سیستم ایمنی بدن ما باید به طور طبیعی سلولهای تومور را به عنوان عامل خارجی تشخیص دهد. اما یک سپر پروتئینی ایست بازرسی میتواند در برابر سرطان محافظت کند.
ایمونوتراپیهای مدرن داروهای شیمیایی نیستند، بلکه آنتیبادیهای آزمایشگاهی هستند که به قسمتهای خاصی از این نقاط بازرسی متصل میشوند و اساساً آنها را خاموش میکنند. پس از خاموش شدن نقطه بازرسی، سیستم ایمنی بدن ما میتواند دوباره سرطان را تشخیص داده و آن را هدف قرار دهد.
درمانهای آنتیبادی که دو پروتئین ایست بازرسی، CTLA-۴ و PD-۱، را هدف قرار میدهند، قبلاً تأیید شدهاند. هر دو سیستم ایمنی ما را خاموش میکنند، اما به روشهای مختلف. از آنجایی که CTLA-۴ و PD-۱ اولین پروتئینهای ایست بازرسی کشف شده بودند، به خوبی مورد مطالعه قرار گرفتهاند و رویکردهای مختلف برای مهار آنها برای درمان سرطان، جایزه نوبل فیزیولوژی یا پزشکی ۲۰۱۸ را برای دانشمندان به ارمغان آورد.
جک سیلبرستین، دانشجوی دکترای ایمونولوژی استنفورد که رهبری این کار را بر عهده داشت، گفت: به نظر میرسد LAG-۳ به شیوهای بسیار متفاوت عمل میکند. دانشمندان امیدوارند که این تفاوتها بتواند آن را به هدفی بهتر یا اضافی برای درمان انواع خاصی از سرطان تبدیل کند.
سیلبرشتاین گفت، به همین دلیل، «در این زمینه هیجان زیادی وجود داشت. گروهها بدون درک کامل از نحوه عملکرد LAG-۳ یا این آنتیبادیها، برای ایجاد آنتیبادی علیه LAG-۳ عجله کردند.»
سیلبرشتاین و همکارانش، از جمله اعضای مرکز دانش ساختار ماکرومولکولی ChEM-H استنفورد و آزمایشگاه شتابدهنده ملی SLAC، کار بر روی ساختار LAG-۳ را در سال ۲۰۱۹ آغاز کردند. ساختار LAG-۳ توسط گروه دیگری در سال ۲۰۲۲ منتشر شد و اولین بینش را در مورد ساختار پروتئین LAG-۳ ارائه داد، اما فاقد جزئیات مهمی در مورد مولکولهای قندی کلیدی برای عملکرد LAG-۳ و همچنین اطلاعات دقیقی در مورد چگونگی ارتباط ساختار LAG-۳ با فعالیت بیولوژیکی آن بود.
وقتی سیلبرشتاین برای اولین بار این پروژه را آغاز کرد، «من به سرعت متوجه شدم که چرا هیچ ساختار منتشر شدهای وجود ندارد. کار با این پروتئین بسیار دشوار است.»
و روشی که سیلبرشتاین برای بدست آوردن ساختار استفاده کرد، که کریستالوگرافی اشعه ایکس نام دارد، فوقالعاده ظریف است. ابتدا، سیلبرشتاین مجبور بود کریستالی را که کاملاً از پروتئین LAG-۳ ساخته شده بود، رشد دهد. سپس، با همکاری ایریمپان متیوز از آزمایشگاه شتابدهنده ملی SLAC، کریستال را با اشعه ایکس بمباران کردند تا تصویری سهبعدی از مولکول ایجاد کنند.
LAG-۳ یک پروتئین دوکی شکل و انعطافپذیر است، بنابراین تا خوردن مولکولها به صورت یک الگوی منظم دشوار است. سیلبرشتاین تخمین میزند که او بیش از ۱۰، ۰۰۰ کریستال ایجاد کرده است که ۳۰۰۰ عدد از آنها با اشعه ایکس بررسی شدهاند، قبل از اینکه تیم سرانجام ساختار آن را بشکند.
سیلبرشتاین گفت: «کار بسیار فشردهای بود و مستلزم سه سال «کوبیدن سر به دیوار» بود.».
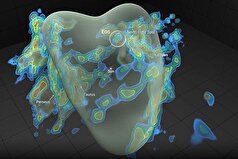
اما این تلاش نتیجه داد. ساختار تیم تأیید کرد که LAG-۳ به عنوان یک دایمر وجود دارد، که در آن دو مولکول LAG-۳ برای تشکیل یک پروتئین ایست بازرسی عملکردی به هم میپیوندند. یک باقیمانده قند که در مطالعات ساختاری قبلی ناشناخته بود، عنصر کلیدی رابط دایمر LAG-۳ است و به جهتگیریهای مختلف پروتئین LAG-۳ کمک میکند.
پس از توصیف ساختار، همکاران دانشگاه نیویورک، از جمله دکتر جاسپر دو، دانشجوی دکترا و استادیار آسیبشناسی، جون وانگ، در آزمایشهای حیاتی برای روشنتر کردن عملکرد LAG-۳ با یکدیگر همکاری کردند. سایر همکاران دانشگاه نیویورک، از جمله کون-وی چانگ و شیانگ-پنگ کونگ، به انجام مطالعات میکروسکوپ الکترونی برای بررسی دقیق چگونگی اختلال در تشکیل دایمر توسط آنتیبادیهای LAG-۳ کمک کردند.
کار بیشتر این گروه برای اولین بار نشان داد که این آنتیبادی، که نزدیک به ۲۰ سال برای نشان دادن اثربخشی درمانی در مدلهای تومور حیوانی استفاده شده است، با اتصال به سطح مشترک بین دو مولکول LAG-۳، فعالیت LAG-۳ را مسدود میکند و از تشکیل یک دایمر LAG-۳ عملکردی جلوگیری میکند. جالب توجه است که آنتیبادیهای LAG-۳ در توسعه بالینی به مناطق دیگری از پروتئین که دور از این سطح مشترک دایمر هستند، متصل میشوند.
هرگز فقط یک «درمان» وجود نخواهد داشت، زیرا هر سرطان متفاوت است و مسیرهای بیوشیمیایی مختلفی را درگیر میکند. سیلبرشتاین و کاکرین آیندهای را تصور میکنند که در آن از انواع رویکردهای درمانی جراحی، شیمیایی و ایمونولوژیکی استفاده میشود که همگی مبتنی بر اکتشافات علمی پایه و نوآوریهای پزشکی هستند. درمانهای اضافی که LAG-۳ را هدف قرار میدهند، ممکن است بخشی از این تصویر باشند.
- لطفا از نوشتن با حروف لاتین (فینگلیش) خودداری نمایید.
- از ارسال دیدگاه های نا مرتبط با متن خبر، تکرار نظر دیگران، توهین به سایر کاربران و ارسال متن های طولانی خودداری نمایید.
- لطفا نظرات بدون بی احترامی، افترا و توهین به مسئولان، اقلیت ها، قومیت ها و ... باشد و به طور کلی مغایرتی با اصول اخلاقی و قوانین کشور نداشته باشد.
- در غیر این صورت، «نگارمگ » مطلب مورد نظر را رد یا بنا به تشخیص خود با ممیزی منتشر خواهد کرد.




- آخرین اخبار
- محبوب
- برچسب های داغ
- باشگاه فوتبال بیرمنگام سیتی قصد دارد یک ورزشگاه ۶۲۰۰۰ نفری با ۱۲ دودکش بسازد
- سطح خواندن و ریاضی دانشآموزان آمریکایی پس از همهگیری کووید-۱۹ همچنان رو به کاهش است
- با وجود بوی تندش! دهانشویه حاوی سیر ممکن است از ضدعفونیکنندههای رایج بهتر عمل کند
- ماسک درباره آینده گردش پول با توسعه هوش مصنوعی صحبت کرد
- عادت بدی که باعث ریزش مو و سفیدی زودرس مو میشود
- لیونل مسی در طول تور هند خود برای هر بازی تا سقف ۱۰۷۰۰۰ دلار دریافت خواهد کرد
- خطرات استفاده روزانه از سشوار
- تعداد بیسابقهای از زنان| از هر پنج آمریکایی، یک نفر میخواهد ایالات متحده را ترک کند
- وقتی اسپانیول سعی کرد لئو مسی را جذب کند...
- فیلم| وزیر معادن کنگو از سقوط هواپیما جان سالم به در برد
- شبکه تلویزیونی ترکیه: علت مرگ گردشگران آلمانی در استانبول، سمی بود که پادزهری نداشت
- مطالعهای ارتباط بین درآمد و زوال عقل را کشف کرد
- ماروتا: برای عاشقان قدیمی، فکر تخریب سن سیرو تلخی و نوستالژی را تداعی میکند
- الگوی جدیدی که خطر مرگ ناشی از سرطان سینه را در ۱۰ سال آینده پیشبینی میکند
- گزارشهای رسانهای: مدیر افبیآی برای نامزدش امنیت خصوصی فراهم میکند
- دانشمندان دریافتهاند که زنان در ورزشهای شدید از مردان پیشی میگیرند
- ثروتمندان بریتانیا با نرخ کمتری نسبت به مردم عادی به خیریهها کمک میکنند
- «به خانه آمدم و گریه کردم»| شزنی، دروازهبان، درباره غمانگیزترین لحظه دوران حرفهایاش میگوید
- مشخص شد که درمان افسردگی در چه سنی آسانتر است
- عکس| فروشگاههای برلین اقدامات جدیدی را برای محافظت از گوشت و ماهی در برابر سرقت انجام میدهند
- مزایا و معایب خوردن کافئین در بارداری!
- باتریهای جدید با ویژگیهای بهتر و کارآمدتر!
- معضل مصرف بیرویه آنتیبیوتیک در ایران به مرز هشدار رسید!
- سالمندان در خصوص تغذیه و فعالیت بدنی این موارد را باید رعایت کنند!
- چربی احشایی چه زمانی برای سلامتی مضر است؟
- وجود حس هفتم در حال تایید است!
- گوشت دایناسورها قبلا قابل خوردن بوده است؟
- چشم سوم چیست؟ چه کاربردی دارد؟
- کشف سنگی عجیب و نادر در مریخ توسط مریخنورد «استقامت»!
- آشنایی با چالشهای زنان در دوران یائسگی!
- هورمون استرس در مادر منجر به رویش سریع دندانهای نوزاد میشود!
- هنگام سرگیجه از مصرف این ۴ گروه غذایی دوری کنید!
- بینی بر رفتار ما تاثیر دارد!
- فعالیت کوتاه چند دقیقهای استرس را کم میکند!
- پنومونی همچنان تهدید جدی برای کودکان و سالمندان!
- رشد مجدد مو به کمک روغن رزماری!
- غلبه بر غم و افسردگی با سادهترین راهکارها!
- سه تغییر کلیدی برای کاهش ابتلا به دیابت نوع ۲!
- کافئین عوارض جانبی دارد؟
- سلولهای بنیادی به کمک ترمیم شکستگیهای ناشی از پوکی استخوان میآیند!
- واکر مخصوص کودکان فلج مغزی ساخته شد!
- درمان دیابت نوع یک ممکن میشود!
- همهگیری بیماریهای مزمن زیر سر غذاهای فوق فرآوریشده است!
- نقش ژنهای مؤثر در ابتلا به سرطان سینه!
- واکسیناسیون آنفلوآنزا برای چه کسانی ضروری است؟
- پیرگوشی در دوران میانسالی چه تاثیری بر زندگی دارد؟
- تب برفکی دامها میتواند وارد چرخه غذایی مردم شود؟
- شایعترین عامل عفونتهای حاد تنفسی چه هستند؟
- وعدههای غذایی دیرهنگام چه تاثیری بر سلامتی دارند؟
- پنج آزمایش واجب برای مردان و زنان پس از چهل سالگی!
- غذاهای فوق فرآوریشده میتوانند باعث دیابت شوند!
- بیماران مبتلا به زخم معده تا چه زمانی نیاز به دارو دارند؟
- بررسی پراکندگی جغرافیایی مصرف آنتیبیوتیکها در کشور!
- نسبت به محصولات تبلیغ شده به عنوان محرک بانوان هوشیار باشید!
- قیمت مکملها و شیرخشک سازمان غذا و دارو چقدر است؟
- مقاومت میکروبی چالش جدید سازمان جهانی بهداشت!
- پوست شما از دیابت خبر میدهد!
- درمان شخصیسازیشده مرگ بخاطر سرطان ریه را از بین میبرد!
- برای کاهش یا رفع ریزش مو چه میتوان کرد؟
- برای حفظ فشار خون سالم چی بخوریم؟
- یک سیستم پلیمری ابر مولکولی که با شدت نور ساختارش تغییر میکند!
- چطور برخی از افراد در به خاطر سپردن چهرهها استاد هستند؟
- یک سیستم هشدار عمومی برای ارسال پیامهای اضطراری!
- شتابدهندهای میکروسکوپی تولید پرتوهای ایکس را ممکن کرد!
- ۳ ماهواره سنجشی ایرانی در دی ماه به فضا میروند!
- زنان باردار واکسیناسیون آنفلوآنزا را جدی بگیرند!
- تولید هیدروژن سبز ممکن شد!
- این ۶ شش نشانه خبر از مشکلات جدی حافظه میدهند!
- توسعه نسل تازهای از موشکهای ضدکشتی با کمک هوش مصنوعی!
- بهترین انتخاب برای رفع یبوست مزمن چیست؟
- رفتوآمد زنبورها چگونه انجام میشود؟
- نایابترین گروه خونی را بشناسید!
- ریتم شبانهروزی بدن چگونه کار میکند؟
- نوشیدن الکل از جمله دلایل ابتلا به سکته!
- ارتباط بین میزان آلودگی ناشی از سوسکها و افزایش سطح آلرژنها!
- کاهش تدریجی حافظه کوتاهمدت با این علائم همراه است!
- چه کنیم تا از سکته در امان بمانیم؟
- راهی تازه برای مقابله با انگلها به کمک میکروبهای تکسلولی!
- کشف نانوکریستالهای مونازیت در گیاه سرخس!
- بازیافت ایمن باتریهای لیتیوم-یون به کمک علم رباتیک!
- جنیفر لارنس توضیح داد که چرا دیگر از ترامپ انتقاد نمیکند: «این کار به آتش ماجرا دامن میزند.»
- نحوه برخورد با شاهزاده هری و مگان مارکل در هالیوود فاش شد
- کیم کارداشیان گفت که به دلیل هوش مصنوعی در امتحانات حقوق خود رد شده است
- مشخص شد که چرا شاهزاده هری از مگان مارکل ناراضی است
- ریچارد گیر راز یک ازدواج شاد را فاش میکند: «من یاد گرفتم که پدر خوبی باشم»
- ستاره فیلم «ایفوریا» برای اولین بار درباره رسوایی تبلیغات شلوار جین صحبت میکند: «یک واکنش غیرمنتظره»
- آلکاراز: من بیشتر اسپانیایی هستم تا یک هوادار رئال مادرید
- کیتی پری دلیل جداییاش از اورلاندو بلوم را فاش کرد
- تیموتی شالامی برای اولین بار درباره رابطهاش با جنر صحبت میکند: «دوست دارم پدر بودن را تجربه کنم.»
- شوهر سابق جنیفر لوپز این بازیگر را به خیانت متهم کرد: «مشکل از خود توست.»
- دلیل واقعی نقل مکان کیت میدلتون به خانه جدید فاش شد
- جنیفر آنیستون درباره رابطهاش با یک متخصص هیپنوتیزم صحبت میکند: «غیرعادی»
- راز انتخاب گوشوارههای کیت میدلتون در محل کار فاش شد
- شوارتزنگر طرح خود را برای «حفظ دموکراسی» در ایالات متحده مطرح کرد
- سلنا گومز در پاسخ به انتقاد هیلی بیبر گفت: «او میتواند هر چه دلش میخواهد بگوید.»
- نظر جاستین بیبر در مورد اختلاف همسرش با سلنا گومز فاش شد
- مشخص شد که چرا پسر بکهامها سعی نمیکند با والدینش آشتی کند
- نیکول کیدمن پس از انتشار خبر طلاقش، میخواهد دوباره با کیث اربن رابطه برقرار کند
- ویکتوریا بکهام درباره قلدری در مدرسه صحبت کرد: «آنها به من میگفتند احمق.»
- دمی مور درباره شغل غیرمعمولی که در ۱۴ سالگی داشت صحبت کرد
- ستاره هالیوود پس از نبردی دردناک با زوال عقل، در بستر مرگ است
- «از صمیم قلب دلم برایت تنگ شده.» لیونل مسی از ورزشگاه بازسازی شده بارسلونا بازدید کرد
- همسر جاستین بیبر در بحبوحه رسوایی گومز، از برنامه خود برای فرزند دوم خبر داد
- کیرا نایتلی توضیح داد که چرا دخترانش را از استفاده از رسانههای اجتماعی منع کرده است
- کیم کارداشیان تغییر مسیر شغلی خود را اعلام کرد
- رامی ملک، بازیگر بینالمللی متولد مصر: برای گرفتن نقشم در این فیلم جنگیدم!
- تینا کندلاکی، ۴۹ ساله، راز ظاهر آراستهاش را فاش کرد
- رونالدو گفت که حتی ترامپ هم از او محبوبیت کمتری دارد
- مشین گان کلی معتقد است که او و مگان فاکس به دلیل چشم زخم از هم جدا شدند
- نامزد سابق تیماتی عوارض تزریقات زیبایی روی بازوهایش را نشان داد: "من هرگز به آن عادت نخواهم کرد. "
- یک دلیل غیرمنتظره آنجلینا جولی را مجبور میکند وارد یک دفتر استخدام نظامی در اوکراین شود
- کندال جنر اعتراف کرد که در کودکی به خواهرش حسادت میکرده است: «حسادت میکردم.»
- شوهر خواننده سیا او را به اعتیاد به مواد مخدر متهم کرد
- همسر ۶۱ ساله باراک اوباما راز زیبایی خود را فاش کرد: «من اخم نمیکنم».
- کیم کارداشیان رابطه اش با دختر ترامپ را فاش کرد
- دلیل نفرت شاهزاده ویلیام از شاهزاده اندرو فاش شد
- کیت میدلتون و ملکه کامیلا اصرار داشتند که شاهزاده اندرو از عناوین خود محروم شود
- دلیل اینکه کیت میدلتون و پرنس ویلیام نقل مکان به خانه جدید را تسریع کردند، فاش شد
- جنیفر آنیستون در کنار نامزد هیپنوتیزم درمانگرش در سریال «عشق من» بازی میکند
- مدونا مخفیانه با معشوق ۲۹ سالهاش نامزد کرده است
- ستاره جنجالی فیلم «ایفوریا» با نامزد سابقش در ماشین مشاجره کرد
- کیت میدلتون و پرنس ویلیام به خاطر نحوه تشکر از کارکنانشان مورد انتقاد قرار گرفتهاند
- ناسا به تردیدهای کیم کارداشیان در مورد فرود بر ماه پاسخ داد
- عکس| مل گیبسون جنجالی بر سر مریم مقدس به پا کرد
- ابتلا به «ویروس اهداکننده»| یک بازیگر مشهور آمریکایی قصد دارد کلیه خود را به یک غریبه اهدا کند
- همسر سابق آرشاوین: او بنتلی من را فروخت، یک مرسدس خرید و مابهالتفاوت را برای خودش نگه داشت
- مسی بهترین ورزشکاران در بین تمام رشتههای ورزشی را انتخاب کرد
- دلیل پاملا اندرسون، ۵۶ ساله، برای کنار گذاشتن آرایش
- جانیک سینر و کیلیان امباپه در رستورانی در پاریس با هم آشنا شدند
- خاطرات قربانی اپستین، افشاگری تکاندهندهای را در مورد شریک زندگی او و یک بازیگر بینالمللی آشکار میکند
- ستاره سریال «بازی تاج و تخت» با نامزد سابق داکوتا جانسون قرار ملاقات میگذارد
- همسر بیبر درباره درمانهای صورتش صحبت میکند
- تیماتی یکی از گرانترین ماشینها را به نامزدش داد
- حمله همسر وزیر بهداشت آمریکا به دلیل «رسوایی پیامکهای جنسی» به یک روزنامهنگار مشهور
- هایدی کلوم به مناسبت تولد ۱۶ سالگی دخترش، عکسی کمیاب از او در کنار دخترش منتشر کرد
- رشفورد نتوانست بین مسی و رونالدو یکی را انتخاب کند
- مودریچ برای همه بازیکنان میلان آیفون خرید تا مجبور نباشد جلوی تیم آهنگ اجرا کند
- عکس| واکنش همسر یاسر الزبیری پس از قهرمانی مراکش در جام جهانی زیر ۲۰ سال فیفا
- نیکول کیدمن ۵۸ ساله راز زیبایی خود را فاش کرد
- شاهزاده اندرو به ارتباط با اپستین در بریتانیا متهم شده است
- حمایت بانکها از بازار سرمایه از فردا اجرا میشود
- بورس سقوط کرده در دولت روحانی چگونه در دولت شهید رئیسی احیا شد؟
- درمان بورسی پزشکیان از زبان عبده
- جذب سرمایه ۷ همتی از بازار بورس دانشبنیانها
- وعده عناب بورسی واقعیتر شد
- چهارمین روز نزولی بازار در غیاب نیروهای صعودی
- انتخابات و دامنه نوسان مهمترین دلیل رکود فعلی بورس
- بورس با ۴ مصوبه دولت برای حمایت از بازار سهام سبزپوش میشود؟
- ۳ دلیل پایین بودن ارزش معاملات خرد در بورس
- معافیتهای مالیاتی بازار سرمایه باید استمرار پیدا کند
- بورس این روزها تحت تأثیر تداوم نرخ اخزای بالای ۳۵ درصد
- رشد شاخصهای بورس با کف سازی تکنیکال
- کاهش دامنه نوسان هم علاج بورس نزولی نبود
- سایه تامین مالی دولت بر سر بورس سنگینی میکند
- کاهش بی سابقه حجم معاملات سهام در بورسهای جهانی
- رشد شاخصهای بورس با کمک بانکیها و اعلام نرخ تسعیر ارز
- حمله به سفیر روسیه در لهستان
- معرفی سری گوشیهای Redmi K ۵۰ قبل از رونمایی رسمی
- غفوری: فکر کردن به قهرمانی از الان، سادهلوحانه است
- کاهش ۱۰ درصدی تولید هوندا در دو کارخانه
- سومین نشست دستمزد، باز هم بدون نتیجه
- لغو بلیت فروشی عمومی المپیک زمستانی چین
- گرامیداشت قربانیان هواپیمای اوکراینی در دانشگاه تورنتو
- ادامه چانهزنی چهارگانه در وین
- صرفهجویی ۱.۶ میلیارد دلاری کمیته برگزاری المپیک و پارالمپیک توکیو
- محبوبترین رشته المپیک توکیو مشخص شد
- اعلام هزینه میزبانی توکیو از المپیک و پارالمپیک ۲۰۲۰،
- آذرتاج: هیات اقتصادی جمهوری آذربایجان به ایران میرود
- بررسی عملکرد ایران در المپیک؛ جایگاه چهارمی در آسیا
- پایان وضعیت اضطراری در کشور میزبان المپیک ۲۰۲۰
- خانواده کوچک، یعنی افتادن در سیاهچاله جمعیتی
- فروتن سینما در ۸۳ سالگی
- راز موفقیت در ازدواج مجدد؛ کلیشهها بیشتر میشود؟
- ماجرای بهنوش و نارسیسم
- هوشمصنوعی مأمور جدید بیبی و فاندبگیرانش
- برادران کارامازوف علیه تکصدایی!
- ارلینگ هالند، معمار رنسانس نروژی
- مفیدترین آجیلها برای سلامتی ما
- نکات طلایی برای داشتن دندانهای سفید و درخشان
- گزارش تکاندهنده سازمان ملل متحد نشان میدهد که ۸۴۰ میلیون زن خشونت فیزیکی یا جنسی را تجربه کردهاند
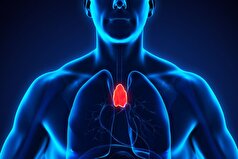
- غده تیموس «بیفایده» ممکن است به مبارزه با سرطان کمک کند
- آزمایش بالینی، داروی جدیدی را برای مبارزه با سل مقاوم به دارو معرفی کرد
- یک متخصص تغذیه درباره خطرات مصرف بیش از حد کواس هشدار داد
- یک داروی جدید کلسترول بد را به میزان بیسابقهای کاهش میدهد
- کووید-۱۹ ممکن است باعث حمله جدید فشار خون بالا شود
- Nutrients: مزایا و معایب رژیم غذایی گیاهخواری
- یک واقعیت علمی اثبات شده: تماس فیزیکی صمیمی، بهبود زخم را تسریع میکند!
- عادتهایی که به تدریج به کبد آسیب میزنند
- دانشمندان ارتباطی بین استقامت قلبی تنفسی و بروز سرطان شناسایی کردهاند
- پیشرفت پزشکی میتواند ریشه دیابت را از بین ببرد
- تکنیک جدید، زمان تشخیص فلج اطفال را به نصف کاهش میدهد
- محققان روشی مؤثر برای بازیابی بینایی پس از سکته مغزی ابداع کردند
- یک باکتری آدمخوار از ایالات متحده، میزان مرگ و میر تا ۱۰۰ درصد دارد
- دانشمندان ارتباطی بین رژیم غذایی و علائم افسردگی و اضطراب شناسایی کردهاند
- مسابقه هوش مصنوعی: کشورهایی که برای رسیدن به ایالات متحده و چین تلاش میکنند
- ورزش خطر اختلالات خواب ناشی از قرار گرفتن در معرض کادمیوم را کاهش میدهد
- تراخم چشمهای اتیوپیاییها را نابود میکند
- افسانه در مورد فواید شیر جو دوسر کارخانهای از بین رفته است
- عینکهای مسدودکننده نور آبی آنطور که تصور میشد مؤثر نیستند
- لبخندی همراه با سلامتی... درمان عفونت دندان از قلب محافظت کرده و قند خون را کاهش میدهد!
- پزشکان سالمترین سبزی را معرفی کردهاند
- ترکیبات طبیعی موجود در قارچهای دکمهای سفید ممکن است برای سلامت حیوانات و انسان مفید باشند
- مطالعه تکان دهنده: بیش از ۱۰۰ نوع دارو سلامت روده را "تهدید" کرده و خطر ابتلا به سرطان را افزایش میدهند
- Nutrients Journal: تأثیر مصرف جو دوسر بر میکروبیوتای روده
- آیا ویروس ماربورگ مصر را تهدید میکند؟ واکنش قاطع دولت
- دانشمندان خواص مفید هل را فهرست کردهاند
- یک جراح عروق هشدار داد که نبض در شکم میتواند نشانه آنوریسم آئورت شکمی باشد
- عواقب مصرف نوشیدنیهای انرژیزا
- پس از دههها رکود، یک درمان جدید برای مالاریا نویدبخش یک پیشرفت بزرگ در مبارزه با این بیماری است
- Neuron: بیماری پارکینسون از روده شروع میشود
- ارز
- طلا
- بورس
- تورم
- اخبار داغ
- ورزشی
- پربیننده
- پربحث
- یک ابر ستارهای عظیم در نزدیکی منظومه شمسی کشف شد
- نبنزیا: دولتهای غربی در مورد رسوایی فساد در اوکراین کاملاً سکوت کردهاند
- زلنسکی علیرغم فشارهای فساد و خواستههای پارلمان، از برکناری یرماک خودداری کرد
- روزنامه وال استریت ژورنال گزارش داد که اتحادیه اروپا در حال تهیه طرح صلح خود برای اوکراین است
- غذاهایی که حتماً باید برای صبحانه بخورید، نامگذاری شدهاند
- نبنزیا: زلنسکی در اروپا گدایی میکند| ارتش اوکراین در حال فروپاشی است و از غیرنظامیان به عنوان سپر انسانی استفاده میکند
- یک اتاق مخفی در هرم خئوپس کشف شد
- یک مورد تکاندهنده: خانوادهای از افراد «بسیار چاق» یک دختر نوجوان را شکنجه کردند، او را سالها زندانی کردند و از غذا محرومش کردند
- اتحادیه اروپا طرح پیشنهادی آمریکا برای اوکراین را «بسیار بد» خواند
- وزیر جنگ آمریکا: هیچ خط قرمزی در مورد ونزوئلا وجود ندارد و قرار دادن حکومت مادورو در فهرست سازمانهای تروریستی، گزینههای جدیدی را در اختیار ما قرار میدهد
- مشخص شد که ایالات متحده در سال ۲۰۱۴ چه کسی را برای پست ریاست جمهوری اوکراین معرفی کرده بود
- یک هنرمند مشهور آمریکایی در ارتباط با پروندهای مرتبط با کمپین انتخاب مجدد اوباما به ۱۴ سال زندان محکوم شد
- دانشمندان از پرخاشگری برخی از پرندگان شگفت زده شدند
- تحلیلی جدی آمریکایی در مورد درگیری نظامی احتمالی غرب با روسیه: دو هفته پس از وقوع جنگ چه اتفاقی خواهد افتاد؟
- فنلاند ممکن است باتلاقهای خشکشده در مرز خود با روسیه را احیا کند
- فرستاده ویژه آمریکا: درگیری در اوکراین نباید از طریق نظامی پایان یابد
- یک پزشک توضیح داد که چرا سکته مغزی به طور فزایندهای در جوانان تشخیص داده میشود
- ترامپ خواستار دستگیری و اعدام اعضای دموکرات کنگره شد| آنها را «خائن» خواند
- اکسیوس: زلنسکی با مذاکره در مورد طرح صلح ترامپ در اوکراین موافقت کرد
- یکی از نمایندگان مجلس ملی طرح صلح ترامپ را منتشر کرد
- یک "سلاح" جدید علیه یک ابرمیکروب خطرناک کشف شده است
- نماینده مجلس اوکراین: زلنسکی باید با شرایط آمریکا موافقت کند
- بلومبرگ: اتحادیه اروپا در ۲۰ نوامبر درباره اعمال تحریمهای جدید علیه نفتکشهای روسی بحث خواهد کرد
- مشخص شد که کدام یک از اعضای تیم ترامپ طرح جدید ایالات متحده برای اوکراین را تدوین کرده است
- دانشمندان دو گونه جدید کروکودیل را در دریای کارائیب کشف کردند
- رئیس جمهور کلمبیا در پاسخ به اتهامات آمریکا مبنی بر قاچاق مواد مخدر، صورتهای مالی خود را منتشر کرد
- نامزد ترامپ برای ریاست سازمان ملل: این سازمان بینالمللی اعتماد مردم آمریکا را از دست داده است
- میوههای نیجریهای ممکن است به سلاحی جدید در مبارزه با سرطان تبدیل شوند
- مجله اسپکتیتور: اروپا نمیتواند کییف را در سطح مورد نیاز تأمین مالی کند
- آمریکا برای یافتن یک قاچاقچی مواد مخدر کانادایی ۱۵ میلیون دلار جایزه تعیین کرد
- دانشمندان راهی برای خنک کردن زمین با استفاده از هواپیماها پیدا کردهاند
- نقش خواب در مکانیسمهای حافظه آشکار شد
- پسکوف: در صورت لزوم، میتوان فوراً گفتگوی تلفنی بین پوتین و ترامپ ترتیب داد
- فرانسه دهها میلیون یورو از داراییهای قاچاقچیان مواد مخدر در امارات را توقیف کرد
- اختلالات متابولیکی که زوال عقل را تهدید میکنند، شناسایی شدهاند
- نیوز نیشن به نقل از یک مقام آمریکایی: یک هیئت نظامی عالی رتبه با ماموریت دوگانه در اوکراین است
- دانشمندان یک سرگرمی ۱۱ دقیقهای را کشف کردهاند که میتواند عمر را طولانیتر کند
- به درخواست بن سلمان، ترامپ مداخله فوری خود را برای پایان دادن به جنگ در سودان اعلام کرد
- کاخ سفید، شبکه خبریایبیسی را به فریبکاری عمدی متهم کرد
- گزارشهای رسانهای نشان میدهد که واشنگتن متحدان اروپایی خود را در جریان طرح جدید حل و فصل بحران اوکراین قرار نداده است
- انبیسی: ترامپ طرح ۲۸ مادهای جدید برای اوکراین را تصویب کرد
- دانشمندان راهی برای تشخیص زودهنگام سرطان پروستات پیدا کردهاند
- ترامپ: واشنگتن قصد دارد جدیدترین انواع سلاحهای آمریکایی را به ریاض بفروشد
- آینده کریمه و دونباس طبق طرح پیشنهادی آمریکا برای پایان دادن به جنگ در اوکراین چیست؟
- سرعت تبدیل زبالههای صنعتی به سنگ، دانشمندان را شوکه کرده است
- فایننشال تایمز: طرح صلح آمریکا شامل به رسمیت شناختن زبان روسی به عنوان زبان رسمی در اوکراین است
- آکسیوس: ویتکوف دیدار خود با زلنسکی را لغو کرد، زیرا زلنسکی از بحث در مورد طرح شهرکسازی ایالات متحده خودداری کرد
- مدارک مربوط به پرونده اپستین ظرف یک ماه در ایالات متحده منتشر خواهد شد
- «عنکبوتهای هیپی» آفریقایی با رفتار خود دانشمندان را شگفتزده کردهاند
- پوتین: روسیه در سال ۲۰۲۶ سفارت خود را در توگو افتتاح خواهد کرد
- نماینده ویژه فرانسه: اوکراین ممکن است در آینده نزدیک دسترسی به وامها را از دست بدهد
- رسانهها از پیشنهادهای صلح روسیه و ایالات متحده برای اوکراین خبر دادند
- ترامپ: ایالات متحده اخراج صدها هزار کارمند دولتی را آغاز کرده است
- افسانه مربوط به افزایش وزن به دلیل هورمونهای استرس از بین رفته است
- فاجعه انسانی در جمهوری دموکراتیک کنگو: دهها نفر پس از غرق شدن یک قایق ناپدید شده و سرنوشت آنها نامعلوم است
- رسانهها: ایالات متحده طبق طرح صلح کاخ سفید، سلاح تأمین نخواهد کرد
- دانشمندان به حل یک راز دیرینه اقلیمی نزدیکتر میشوند
- آنکارا هرگونه وقفه در تامین گاز روسیه را رد میکند و ادامه آن را طبق قراردادهای امضا شده تأیید میکند
- دختر رئیس جمهور تانزانیا به عنوان معاون وزیر آموزش و پرورش سوگند یاد کرد
- ترامپ گفت که از ادامه درگیریهای اوکراین «شگفتزده» شده است
- تیلور گرین: قانونگذاران آمریکایی ممکن است به اتفاق آرا انتشار اسناد اپستین را تصویب کنند
- فنلاند یک میلیارد یورو وام دفاعی از اتحادیه اروپا دریافت میکند
- کشف تناوب غیرعادی سنگهای روشن و تیره در مریخ
- پسکوف: بیشتر پولی که دولت بایدن به اوکراین اختصاص داده بود، در کییف اختلاس شد
- پوتین و سیسی در نصب مخزن رآکتور اولین نیروگاه هستهای مصر شرکت خواهند کرد
- اردن: پدر عروس به دلیلی عجیب داماد را بیرون کرد و عروسی را لغو کرد!
- دانشمندان کشف کردهاند که چگونه باکتریها برای حمله به بدن انسان آماده میشوند
- لهستان سطح تهدید تروریستی در راهآهن این کشور را افزایش داد
- یک مقام ارشد آلمانی احتمال از سرگیری واردات گاز روسیه توسط کشورش را رد نکرد
- یک سیاستمدار اروپایی با درخواستی در مورد اوکراین به مدودف مراجعه کرد
- جادوی یک دست: دانشمندان راز مصونیت قوی را با واکسیناسیون مجدد کشف کردند
- فرانسه: هزینههای تمدید طول عمر نیروگاههای هستهای از ۱۰۰ میلیارد یورو فراتر خواهد رفت
- تحقیقات جدید فرانسه در مورد تأمین مالی غیرقانونی مبارزات انتخاباتی مکرون
- یک متخصص دستورالعملهایی برای حفظ سفتی و درخشندگی پوست به اشتراک گذاشت
- کاهش قدرت عضلانی با افزایش سن، خطر مرگ ناشی از زمین خوردن را افزایش میدهد
- چگونه منافذ پوست را کمتر دیده و چین و چروکها را کاهش دهیم
- یک ویژگی غیرمنتظره تستوسترون، کلیشههای مربوط به «هورمون پرخاشگری» را رد کرده است
- یک متخصص به اوکراینیها توصیه میکند که برای تخریب احتمالی نیروگاه برق آبی کیف آماده باشند: پایتخت شما فوراً زیر آب خواهد رفت
- کنسول روسیه در مارسی: مقامات شهری، امنیت ساختمان کنسولگری را کاهش دادند
- گفته شد که چگونه یاد بگیرند استرس را مدیریت کنیم
- آرسنال به مکتامینی علاقهمند است، ناپولی این بازیکن را با قیمتی کمتر از ۸۰ میلیون یورو نمیفروشد
- زنگ خطر برای مارک آندره تراشتگن به صدا درآمده است
- حرکات قابل توجه کیس اسمیت
- مورد انتظارترین تصمیم ابراهیما کوناته
- رئیس بارسلونا در مورد بازگشت مسی گفت: «اگر در گذشته زندگی کنید، نمیتوانید به جلو حرکت کنید.»
- لیائو در مورد پولیسیچ: او برای ما بسیار مهم است و میتواند در هر شرایطی روند بازی را تغییر دهد
- اکیتیکو در مورد اولین گلش برای تیم ملی فرانسه اظهار نظر کرد
- «رئال مادرید خانه اشرف است»
- باشگاه بارسلونا از جروم بواتنگ استقبال میکند
- دربی در شمال انگلستان اثر متئو گوندوزی
- پلتنبرگ میگوید رئال مادرید و رودیگر آماده ادامه مذاکرات تمدید قرارداد هستند
- هفت روزی که میتواند آینده آرسنال را رقم بزند
- مهاجم میلان، لیائو، فاش کرد که کدام سبک بازی بیشتر به او میآید
- فرصتی برای جذب رودری هرناندز
- زلزله لیگ برتر را تهدید میکند
- رابیو، بازیکن میلان: آلگری همیشه مثبت اندیش است و میداند چگونه با همه ارتباط برقرار کند
- سولاری، وینگر اسپارتاک، آماده بازگشت به آرژانتین است
- کورتوا کارلو آنچلوتی و ژابی آلونسو را مقایسه کرد
- رابیو، بازیکن میلان: هیچ ورزشکاری از مصدومیت خوشش نمیآید. دلم برای زمین تنگ شده!
- صحبتهای خوان لاپورتا در مورد مسی
- تصمیم عجیب رئال مادرید در مورد چما آندرس
- «فکر میکنم اتا ایونگ میتواند به بارسلونا برود»
- منچسترسیتی آماده است تا برای جذب لیورامنتو، پول و یک بازیکن پیشنهاد دهد
- موزتی بازیکنان برتر تنیس را با اسطورههای یوونتوس مقایسه کرد
- رابیو، بازیکن میلان، درباره بازی مقابل اینتر گفت: «من واقعاً از این نوع مسابقات لذت میبرم.»
- آدمولا لوکمن، خرید جدید
- مانوئل آکانجی همه چیز را روشن میکند
- بیانیه مهم بایرن مونیخ در مورد اوپامکانو
- رابیو، بازیکن میلان، درباره مبارزه برای قهرمانی در این فصل صحبت کرد
- آلبا در مورد عکسهای بازدید مسی از نیوکمپ اظهار نظر کرد
- بارسلونا میتواند از تراشتگن ۸ میلیون یورو درآمد کسب کند
- فرانکو ماستانتوئونو و اتلتیکو مادرید
- جیمز رودریگز ممکن است به اسپانیا بازگردد
- دروازهبان یوونتوس در واکنش به اخراج تودور گفت: «ما احساس مسئولیت میکنیم.»
- نامزد ریاست بارسلونا: اولین کسی که بعد از پیروزی با او تماس خواهم گرفت، مسی است
- امباپه به حکیمی به خاطر کسب جایزه بهترین بازیکن سال آفریقا در سال ۲۰۲۵ تبریک گفت
- مارسکا دستهایش را به هم میمالد: چلسی یک بازیکن جدید خریده است... برای سال ۲۰۲۸!
- بایرن مونیخ پیش از پنجره نقل و انتقالات زمستانی تصمیم مهمی گرفت
- تیم جدیدی وارد رقابت برای جذب کریم آدیمی میشود
- آلمان، سوئیس و اتریش برای اولین بار پس از ۷۲ سال در یک جام جهانی با هم بازی خواهند کرد
- پوچتینو پس از شکست اروگوئه به یک روزنامهنگار گفت: «من مربی تیم ملی آمریکا هستم، نه نظافتچی.»
- رسانهها فاش کردند که کار بر روی طرح جدید آمریکا برای اوکراین چه زمانی آغاز شد
- کیهلینی درباره اسپالتی: او با مردم، صرف نظر از جایگاهشان در باشگاه، همدردی میکند
- اینترمیلان در حال بررسی سرمایهگذاری ۲۳ میلیون یورویی برای یک بازیکن است
- چلسی میتواند بازیکنی را از بارسلونا بقاپد
- آنتونی، انتقال به رئال بتیس را تسهیل کرد
- آلابا درباره صعود تیم ملی اتریش به جام جهانی ۲۰۲۶ گفت: «به اتریشی بودنم افتخار میکنم.»
- کیهلینی، مدیر یوونتوس: ما در حال کار بر روی قرارداد جدید برای ییلدیز هستیم
- بازیکن بنفیکا به دلیل انتشار ویدیوی مستهجن به حبس تعلیقی محکوم شد
- امضای قرارداد با آلخاندرو گریمالدو امکانپذیر است
- کیلیان زودتر میخواست به رئال مادرید برود
- رئال مادرید همچنان در رقابت برای جذب رودریگو مندوزا باقی مانده است
- مارکا: بایرن و بارسلونا به مدافع بایر لورکوزن علاقه دارند
- آنتونی پس از ترک منچستریونایتد: «احساس بیاحترامی کردم.»
- بارسلونا برای اولین بازی خود در نیوکمپ پس از افتتاحیه، سورپرایزی را اعلام کرد
- تصمیم اتلتیکو مادرید در مورد آدمولا لوکمن
- در حال حاضر اقداماتی در مورد آنتونیو رودیگر انجام شده است
- پابلو سارابیا اعلامیه بزرگی از قطر ارائه داد
- بارسلونا از لواندوفسکی خواست که برای جلوگیری از پرداخت باج به بایرن مونیخ، گلهای کمتری به ثمر برساند
- آرتتا: گواردیولا قهرمان من به عنوان بازیکن بود| کار کردن با او یکی از بهترین تصمیماتی بود که گرفتهام
- لونین در مورد بازی برای اوکراین گفت: «نمیتوانم ساکت بمانم، مخصوصاً وقتی که دارند سعی میکنند نام مرا لکهدار کنند.»
- کارلوس سولر از مردم درخواست صبر و شکیبایی دارد
- اریک گارسیا، موضوع مهر و موم شده
- مارک گوئهی، خرید جدید است
- تیاگو سیلوا، ۴۱ ساله، در حال بررسی گزینههای خود برای بازگشت به اروپا است
- کارمبئو، ماتراتزی و دالین به عنوان دستیاران قرعهکشی مرحله پلیآف جام جهانی ۲۰۲۶ منصوب شدند
- اتحادیه فوتبال روسیه قصد دارد قبل از SPIEF در سال ۲۰۲۶، مسابقه اسطورههای روسیه و برزیل را برگزار کند
- دستمزد کاسمیرو آینده او را تعیین خواهد کرد
- کوکه هنوز چیزهای زیادی برای ارائه به اتلتیکو دارد
- تلاش نهایی الکسیس سائلماکرز
- لبوف درباره احتمال انتصاب زیدان به عنوان سرمربی تیم ملی فرانسه صحبت کرد
- تونی کروس از وینیسیوس انتقاد کرد
- کلیشی: آرسنال طبق این اصل بازی میکند: نکته اصلی بردن جام است
- رقابت برای جذب اونای لوپز شدت گرفت
- همین الان یه جایگزین برای نیکو پاز پیدا شده!
- مصدومیت ادر میلیتائو اکنون مشخص شده است
- نمانیا ماتیچ از منچستریونایتد به خاطر فروش مکتامینای به ناپولی انتقاد کرد
- روزنامه نگار پیرس مورگان به دیدار رونالدو و ترامپ واکنش نشان داد
- اکیپ: پوگبا، هافبک موناکو، برای اولین بار پس از دو سال مقابل رن بازی خواهد کرد
- باشگاه فوتبال بارسلونا در حال آماده شدن برای یک انقلاب داخلی است